第一章: 金沢への道程
第二章: スフィンゴシン-1-リン酸情報伝達系の発見と展開
第三章: 血管収縮のRho情報伝達系の発見と展開
第一章:金沢への道程
私は島根県大原郡木次町に生まれ、松江北高校理数科から東大医学部へ進学しました。木次町はスサノオノミコトとヤマタノオロチの神話に登場する斐伊川のほとりの緑豊かな田舎町です。(ちなみに斐伊川上流には、あの「もののけ姫」の舞台のモデルと考えられる「たたら製鉄」の遺跡があり、また現在も当地の鉄を原料としてきわめてすぐれた刀鍛冶が継承されているということです。)そのいわば日本の原風景のなかで、私は材木屋の長男としてのんびりとした幼少年時代を過ごしました。(こんなことを書くのも、私の人となりを知っていただく一助となればと思ってのことです。)肝炎ウイルスの世界的権威である新聞にもよく登場する三代俊治先生は木次の数軒先がご実家で、松江北高の6年先輩であります。
さて、医学部卒業後、内科研修を経て尾形悦郎先生の主宰される東大第四内科に入局、みっちりと臨床の力を鍛えられました。この時期とくに内分泌の勉強を猛烈にやり、尾形先生のご推挙により中山書店から出版された内科学体系の共著者のひとりに加えていただいたりもしました。私の研究テーマとなった情報伝達に対するあくなき興味はこのころ確立されたといえます。 1985年1月から、米国東海岸はコネチカット州New HavenのYale大学Cell Biology, Physiology ならびにInternal Medicineの教授である、Howard Rasmussen教授のもとへ留学しました。Rasmussen教授は、カルシウムイオンが細胞内セカンドメッセンジャーであることを最初に看破した科学者です(Science 1973)。また多くの若い人材を育て上げた偉大なMENTORでもあり、日本人では尾形悦郎先生、黒川清先生(米国UCLA教授を経て現在日本学術会議会長)をはじめとするわが国の数多くのリーダーの共通の師匠です。Rasmussen教授のもとで私は当時未開の領域であった平滑筋の情報伝達機構の研究に着手しました。約20年も昔になる当時は細胞内カルシウムイオン濃度を測定する試薬としてfura2/AMなどはまだ存在しない時代で、発光クラゲ由来のカルシウム感応性発光色素エクオリン(aequorin)を用い、これを血管・気管支平滑筋にとりこませて、平滑筋を収縮させるアゴニストが細胞内外からのカルシウム動員により細胞内カルシウムイオン濃度を上昇させることを世界に先駆けて明らかに出来ました[JCI(1987), Am J Physiol(1987), JBC(1988)]。また、平滑筋を弛緩させる心房性ナトリウム利尿ペプチド(ANP)は細胞内Ca2+濃度を低下させることなくミオシン軽鎖リン酸化レベルを低下させることを初めて示しました[JBC(1988)]。一方、平滑筋に3H標識イノシトールを取り込ませ、平滑筋を収縮させるアゴニストがイノシトール脂質代謝回転の亢進、ホスホリパーゼC活性化、カルシウム動員のセカンドメッセンジャーであるイノシトール三燐酸の産生を引きこすことを証明しました[JBC(1986), Hypertension(1987)]。当時は西塚泰美先生・高井義美先生の発見されたCキナーゼが情報伝達の世界を席巻していましたが、われわれは平滑筋収縮においてとくにその持続相がCキナーゼに依存することを見出しました[FASEB J(1987)]。また、平滑筋を収縮させるアゴニスト刺激により、Cキナーゼ活性化のセカンドメッセンジャーである1,2-ジアシルグリセロールの絶対量が平滑筋組織で実際増加することをはじめて証明しました[JBC(1986)]。深夜、燐絶対定量のためオーブンで平滑筋組織を塩酸処理していると火災報知器が鳴り響き、やがて屈強の消防士一団がなだれ込んできたことなど、懐かしい思い出です。さらに平滑筋組織を32Pで代謝標識し、二次元電気泳動によりリン酸化蛋白の解析を行いました[Mol Cell Endocrinol(1988)]。これら一連の実験により、平滑筋収縮の細胞内情報伝達研究の最初の1ページに数行を書き加えることができたことは、Howardとの出会いとともに私にとって得難い幸運でありました。
1987年9月、思い出深きNew Havenをあとにし、帰国して筑波大学臨床医学系代謝内分泌内科講師として、昼は臨床、夜は研究の生活が始まりました。このころ、ちょうど筑波では真崎知生先生の薬理学グループで当時大学院生だった柳沢正史博士、東大から国内留学していた栗原裕基博士、後藤勝年助教授(現筑波大教授)、生化学の木村定雄講師(現千葉大教授)たちが中心になって新規血管作動物質エンドセリンの研究がさかんに行われていました。このタイムリーな時期に私は、エンドセリンがG蛋白共役型受容体を介してホスホリパーゼCを活性化しカルシウム動員を引き起こす、これまで私が見てきた典型的な血管収縮性アゴニストと全く同様の機序で作用することを見出しました[PNAS (1989), JCI(1990)]。また、当時大学院生であった桜井武博士と共同で、クローニングした新規受容体がエンドセリンETB 受容体であることを同定しました[Nature(1990)]。またエンドセリンの複数の血管外作用について初めて明らかにしました[JBC(1989), Am J Physiol(1989), BBRC(1990)]。これらの研究で内分泌学会奨励賞を受賞しました。筑波ではまた、私のはじめての弟子である医学修士課程の学生さんたちと一緒に実験し、苦楽をともにしました。彼らは現在立派な研究者として公立や企業の研究所で活躍しており、交流が続いています。
1991年7月、東大医学部に初めて設置された寄附講座(二人助教授制)に助教授として赴任しました。ここでは血管壁に存在する未知の情報伝達機構の解明を目指し、ラット大動脈平滑筋cDNAライブラリーから新規G蛋白共役型受容体をいくつかクローニングしました。そのうちの一つは現在P2Y6と称されているプリン受容体[JBC(1995)]で、もう一つはその後、われわれ自身がリガンドを同定し、細胞内情報伝達機構を明らかにし、現在生体における生理機能を解明しつつあるスフィンゴシン-1-リン酸 (S1P) 受容体です[BBRC(1993)]。これについては後述しましょう。東大の研究室ではまた、動脈硬化の病態生理学解明をめざし、ラット頚動脈血管内膜肥厚のモデルを用い、血小板由来成長因子(PDGF) 受容体活性化が血管内膜肥厚に先行して生じていること[Circulation(1997)]、またPDGF発現にアンギオテンシンIIが関与していること[Cir Res(1999)]を証明し、さらに、PDGF 受容体細胞外ドメインをアデノウイルスベクターで発現させる遺伝子治療が奏功することを見出しました[Gene Therapy(1999)]。また不安定狭心症の患者さんの冠動脈肥厚内膜除去術で得られたサンプルにおいて実際PDGF受容体活性化を証明しました[Heart(1998)]。また、P2Y受容体に関連してこの頃、血管平滑筋に伸展力を負荷すると血管拡張作用を持つ生理活性ペプチドPTHrPの遺伝子発現が増強すること[JBC(1994), Hypertension(1997)]、この分子機序として伸展力が平滑筋から細胞外へATP放出を引き起こし、放出されたATPが平滑筋細胞膜上のP2Y受容体を介してJNKを活性化するシグナル経路の重要性を明らかにしました[JBC(1998)]。東大の研究室で明らかにしたもう一つの大きな成果は、平滑筋収縮に低分子量G蛋白Rhoがかかわっていることの発見です[FEBS Lett(1995)]。細胞膜が低分子量の物質を透過できるように処理した平滑筋細胞を用いて、Rhoがミオシン脱リン酸化酵素を抑制することによりミオシンのリン酸化レベルを上昇させ、この機序により、同じ細胞内カルシウム濃度において収縮を増強することを証明しました。このRho経路は、ミオシンリン酸化酵素によるミオシンリン酸化と協調して働く、いわゆるカルシウム センシタイゼーションの分子基盤であると考えられます。この成果は、その後当研究室における平滑筋収縮とRhoの研究の発展に結びついて行きます(後述)。
1999年1月、金沢大学医学部に生理学第一講座教授として着任しました。当然のごとく、雪におおわれた金沢でしたが、東京から来た人間には日本海の魚、地ものの野菜など、とにかく安くてうまいのには驚きました。すこし車を走らせればすぐに海、山、そして温泉。この恵まれた環境は、食べ物が極上である分、New Havenをはるかにしのぐものです。このご縁に感謝しつつ、後述のように研究を発展させています。
第二章:スフィンゴシン-1-リン酸情報伝達系の発見と展開 目次へ
すでに書いたように10年以上も前、血管壁に存在する未知の情報伝達機構の解明を目指し、ラット大動脈平滑筋cDNAライブラリーから新規G蛋白共役型受容体をいくつかクローニングしました。Arterial G protein-coupled Receptor にちなんで名づけたAGRシリーズのこれら受容体は、その時点ではリガンドが不明のオーファン(みなしご)G蛋白共役型受容体でした。このうちAGR16についてはこれが、かねてから多彩な生物活性を示すことから注目を集めて来た、血漿中に存在するリゾリン脂質、スフィンゴシン-1-リン酸 (S1P) の受容体であることをつきとめました[Biochem J(1999)]。また当時、AGR16と高い相同性を有するものとして唯一報告されていた、やはりリガンドが不明のオーファン受容体Edg1と、のちにこれらと相同なものとして報告されたEdg3もまたS1P受容体であることを、世界の他の研究グループとほぼ同時に見出しました[JBC(1998), BBRC(1999)]。一方、血清中の古典的生理活性脂質として古くから知られていたリゾホスファチジン酸 (LPA) は、実はS1P と似た立体構造を有しているのですが、興味あることにLPA 受容体とS1P受容体は同一のファミリー (EdgファミリーG蛋白共役型受容体群) に属することも次第に明らかになりました。現在では5つのS1P受容体サブタイプと3つのLPA 受容体サブタイプの存在が明らかにされ、それぞれ発見の早いものから命名しなおされてS1P1 〜S1P5、LPA1 〜 LPA2と新しい名で呼ばれるようになっています。われわれの見出したAGR16はEdg5、ついでS1P2と命名されています。
さて、それではなぜ、こんなにたくさんの受容体サブタイプが存在するのでしょうか。S1Pが生体にとってかけがえのない一次メッセンジャーであり、その作用が途絶えるのを予防するため、系統発生の過程で複数の受容体サブタイプを用意するに至ったという可能性があります。またS1Pが多彩な生物活性を示すことは、複数のS1P受容体サブタイプが別々の生物活性を担っていることを示唆します。とくに注目されるのは、S1Pの細胞運動に対する効果です。すなわち、S1Pはある種の細胞(血管内皮細胞など)に対してはその細胞を引きつけるような運動(化学遊走)をひきおこし、また別の細胞(血管平滑筋細胞やある種のがん細胞)に対しては全く逆にその細胞運動を強力に抑制することが知られており、このS1Pの細胞運動に対する相反する二面性効果については、S1Pの細胞内効果であると主張する研究者もいて、その分子機構は不明のまま、長年論争の種となっていました。
この問題を解明するため、金沢においてわれわれの研究室ではまず、Edg1(=S1P1 )、 Edg5(=S1P2 )、Edg3(=S1P2 )の3つの広汎に発現するS1P受容体サブタイプについて、その細胞内情報伝達機構と生物活性の相違を明らかにしました。その結果分ったことは、これらは良く似ているけれどじつは全く違う機能を担っているということです。すなわち、いずれもGiと共役してRas-ERK/MAPキナーゼ経路を活性化し、GiあるいはGqと共役してホスフォリパーゼC(PLC)-カルシウム動員・Cキナーゼ経路を活性化する点、よく似ています[JBC(1998), Biochem J(1999), BBRC(1999)]。ところが、全く異なる点として、Edg1とEdg3はS1Pに対する化学遊走受容体として機能し、S1Pの濃度勾配に応じた化学遊走反応を担っているのに対し、 Edg5は逆に、他の走化因子に対する遊走を強力に抑制することをはじめて明らかにしました[MCB(2000), 以下総説 Mol Cell endcrinol(2001), J Biochem(2002), BBA(2002)]。Edg5はこのように細胞運動を負に制御するG蛋白共役型受容体として最初に発見されたものになります。さらにこれら相反する作用の細胞内分子機構を調べた結果、Edg1とEdg3はGiを介し分子量G蛋白Racを活性化し、このRac活性化が化学遊走反応に必須であること、一方、Edg5は全く逆に、他の走化因子によって活性化されるべきRacを完全に抑制してしまうことをつきとめました[MCB(2000)](図1)。これら一連の研究により、長年にわたり論争が続いていた、S1Pの細胞運動に対する正負両方向の二面性制御作用が、異なるS1P受容体サブタイプの機能に基づく生物現象であることを明らかにすることが出来ました。さらに詳しい解析の結果、Edg5はG12/13を介して低分子量G蛋白Rhoを活性化し、このRhoがRac抑制の上流に位置すること、活性化Rho はRacのGTP分解活性を亢進させる結果Rac抑制を引き起こすこと、また本来はS1Pに対する化学遊走受容体として機能するEdg3は、Rhoと強力に共役するよう細胞内で分子操作してやるとGi-Rac経路との共役を凌いでこれを抑制し、あたかもEdg5のごとく遊走抑制性受容体として働くようになることなどを見出しました[MCB(2003)]。これらの研究成果はScience誌のThis Week in Signal Transductionに取り上げられるなど、細胞運動の研究分野に大きなインパクトを与えました。
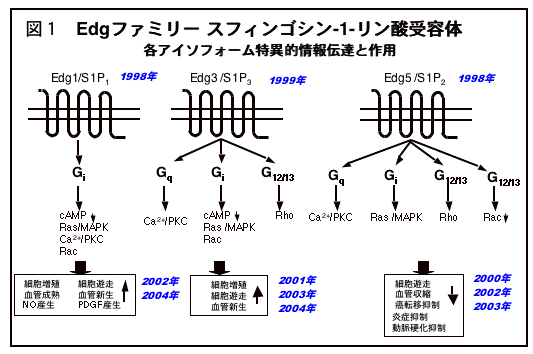
このようなS1P受容体サブタイプ特異的な細胞運動に対する正負両方向の二面性制御作用は、生物学的にどのような意義をもっているのでしょうか。私たちは手始めに、生体内でその細胞運動がきわめて注目されるがん細胞について、これらS1P受容体のそれぞれを発現させてその挙動を調べました。マウスメラノーマB16細胞はS1Pにより細胞運動と細胞外マトリックス内浸潤が抑制されることが良く知られていました。この細胞はS1P受容体のうちEdg5のみを内因性に発現しており、この内因性Edg5が実際にS1Pによる抑制作用をひとえに担っていることを証明しました[JBC(2003)]。また、B16細胞にEdg5を強発現させると、S1Pによる細胞運動と細胞外マトリックス内浸潤の抑制効果が増強されること、逆に化学遊走受容体であるEdg1 あるいはEdg3を強発現させるとS1Pの抑制効果が減弱し、むしろ細胞運動と浸潤が増強される反転現象が見られることを見出しました。さらに、マウス尾静脈からB16細胞を注入し、3週間後に肺転移を調べるin vivo血行性転移実験系を用い、尾静脈注入前にS1Pで処理することにより、肺転移が容量依存性に抑制されることを発見しました[Biochem J(2003)]。このin vivo実験系においても、B16細胞にEdg5を強発現させると、S1P処理による肺転移抑制効果が増強されること、逆にEdg1 あるいはEdg3の強発現細胞においては、S1P処理がむしろ肺転移を増悪させることを見出しました。これらの知見は、Edg5特異的アゴニストや、Edg1 あるいはEdg3特異的なアンタゴニストががんの転移を抑制する有望な治療薬であることを示唆します。このアイデアを実現するためには今後さらに研究を重ねることが必要ですが、これらS1P受容体が生体のさまざまな組織に広範に発現している事実は、そこから発生したがん細胞もまたしかり、ということを意味します。これら受容体サブタイプ特異的治療薬によるオーダーメイド治療が実際奏功すると期待されるゆえんです。
さて、わが国も含めて、先進国の死因のトップ双璧は、がんと、血管リモデリングに基づく虚血性疾患、すなわち心筋梗塞や脳卒中です。私たちはS1P情報伝達系がこの血管リモデリングの病態生理においても重要な役割を担っていることを強く示唆する所見を得ています。血管中膜を形成する平滑筋細胞は、正常にはEdg5を強く発現しており、10-7 mol/Lのオーダーで血漿中に存在するS1Pに反応して内膜側に遊走するのを常時抑制していると考えられます[Cir Res(2002)]。血管内膜すなわち内皮細胞が物理的・生化学的に傷害されると平滑筋細胞がトランスフォームして新生内膜細胞になり、これが増殖し細胞外マトリックスを産生して血管内腔狭窄を起こすわけですが、まず、新生内膜細胞はEdg1を強く発現するようになることを見出しました[137]。その結果、内膜側に遊走するようになると考えられます。傷害内膜において活性化された血小板は大量のS1Pを放出するのですが、このS1Pは、新生内膜細胞のEdg1-Gi情報伝達系を介して作用し、われわれ自身がかつて血管リモデリングに深くかかわっている事を証明したPDGFの発現を引き起こすこと、Edg1-Gi情報伝達系の下流において、血管リモデリングの立役者として最近注目されている転写因子KLF5を活性化することがPDGF発現の主要な経路であることをつきとめました[JBC(2004)]。
これらがんの浸潤・転移や血管リモデリングにおけるS1P情報伝達系の役割の解明は、成人病の克服に連なる重要な研究課題です。これと平行して、S1P情報伝達系の生理機能の解明も進めています。現段階ではまだ公表できませんが、数種類の遺伝子改変マウス(ノックアウトマウスならびにトランスジェニックマウス)を作出して幾つかのきわめて興味ある所見を得ています。
第三章:血管収縮のRho情報伝達系の発見と展開 目次へ
S1P情報伝達系の研究と並ぶ当研究室のもう一つの大きな研究テーマは平滑筋収縮の細胞内情報伝達系の解明です。私はもう20年来これに取り組んで来ました。
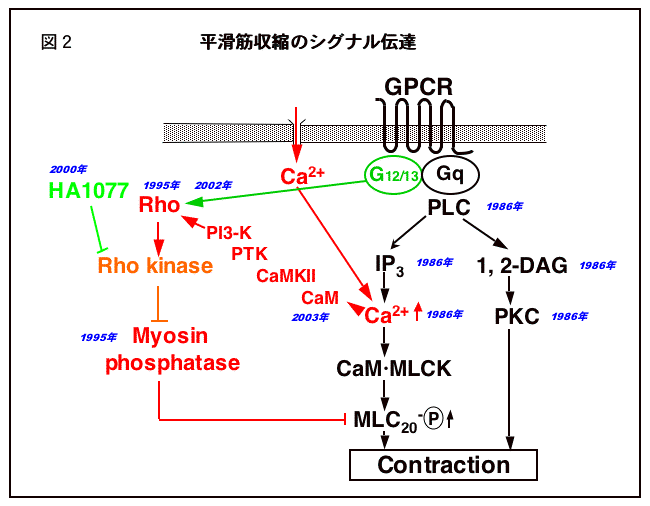
留学時代(1985-87年)には、それまで明らかになっていなかった平滑筋興奮時の細胞内カルシウム動態とその機序、すなわち、平滑筋収縮に働くアゴニストはホスホリパーゼC(PLC)を活性化し、その結果イノシトール三リン酸上昇を介し、細胞内外からの二相性のカルシウム動員を引き起こすことを証明しました[JBC(1986), JCI(1987), Am J Physiol(1987), JBC(1988), Mol Cell Endocrinol(1988)]。これらの知見は今ではもはや常識となっています。またCキナーゼのセカンドメッセンジャー、1, 2-ジアシルグリセロール絶対定量によるその持続性産生の証明とともに、二次元電気泳動法を駆使して平滑筋リン酸化蛋白の解析を行い、アゴニストがカルシウム動員と同時にCキナーゼを活性化することを初めて示しました[JBC(1986), FASEB J(1987), Mol Cell Endcrinol(1988) ]。カルシウム動員は、Ca2+依存性酵素であるミオシン軽鎖キナーゼ活性化とこれによるミオシン軽鎖のリン酸化を引きこし、これが平滑筋収縮の引き金となるわけです。一方、Cキナーゼについても、当時は平滑筋における役割は全く不明であったのですが、私達はCキナーゼが収縮の持続相に関与することを初めて見出しました[FASEB J(1987)]。近年に至り、Cキナーゼの下流の分子機構が明らかにされつつあります。
Ca2+-ミオシン軽鎖キナーゼ並びにCキナーゼ経路から成るこれら平滑筋細胞内情報伝達の2大経路に加え、90年代半ばに平滑筋収縮制御の第3の経路を発見し、報告することが出来ました。1990年頃より、リン酸化されたミオシン軽鎖を脱リン酸化するミオシンホスファターゼを抑制する分子機構の存在が示唆されていましたが、その実体は不明でした。私達は、低分子量G蛋白Rhoがこのミオシンホスファターゼの抑制性制御に関与している中心的シグナル伝達分子であることを、1995年に世界で初めて示しました[FEBS Lett(1995)]。すなわち、Rho依存性の情報伝達経路がミオシン軽鎖の脱リン酸化を抑制することにより、結果としてミオシン軽鎖リン酸化レベルを高値に維持し、収縮を維持する役割を担っていることの発見です。その後、Rhoによるミオシン軽鎖ホスファターゼの抑制がRhoの標的分子のひとつRhoキナーゼによって媒介されることが、わが国の貝淵幸三先生、伊藤正明先生の研究室から報告されました。ついで成宮周先生、上畑雅義博士のグループにより、Rhoキナーゼ阻害薬Y−27632が見出され、Rhoキナーゼ研究に拍車がかかりました。一方私達も、旭化成の佐々木泰治博士のグループとの共同研究で、当時既に脳血管攣縮の治療薬として臨床に用いられていたファスジル(HA-1077)が、実はRhoキナーゼ特異的な阻害薬であることを見出し、実際、Rhoを介したミオシンホスファターゼ抑制を強力に解除し、ミオシンリン酸化レベルを低下させ、平滑筋弛緩に導くことを報告しました[Am J Physiol(2000), J Physiol(2003) ]。ファスジルがどのようにして脳血管攣縮を軽減するのか作用機序を明らかにし、同時に、脳血管攣縮にRhoキナーゼ活性化が深く関っていることを明らかにしたわけです。このような私達の一連の研究は現在のRho - Rhoキナーゼ- ミオシン軽鎖ホスファターゼ経路に関する研究の隆盛に先鞭をつけたものと自負しています。
私たちはその後、血管収縮性アゴニストが実際に平滑筋組織においてRho活性化を引き起こすことを世界に先駆けて報告しました[Am J Physiol(2001)]。これはわれわれのもうひとつの研究プロジェクトであるS1P情報伝達系の研究の過程でRho活性化のアッセイ法が確立していたことも幸いして得られた知見といえます。私たちはさらに最近、驚くべきことに、平滑筋組織において細胞内Ca2+がRho活性化のセカンドメッセンジャーとして重要な役割を演じていることを見出しました[Cir Res(2003)]。すなわち、平滑筋は高濃度KClにさらされると細胞膜が脱分極し、その結果電位依存性のLタイプCa2+チャネルが開口して細胞外からCa2+流入が起こりますが、このとき、Rho活性化が生じていたのです。この発見は、Ca2+がミオシン軽鎖をリン酸化するミオシン軽鎖キナーゼを活性化すると同時に、これを脱リン酸化するミオシンホスファターゼを抑制するという二つの大きな機能を果たしていることを明らかにしたものです。これまでに深く関わってきた平滑筋収縮の細胞内情報伝達のシェーマを大きく書き替えるほどのインパクトがあるものと言えます(図2)。これらの成果は2005年3月の国際生理学会議の招待講演で話す予定です。今後さらに、Ca2+がどのようにしてRho活性化を引き起こすのかを含め、平滑筋収縮の細胞内情報伝達を明らかにしていきたいと思っています。既にRho活性化に関与する新しいシグナル分子を見出しており、現在精力的に研究を進めています。
このような研究を通じて癌、血管リモデリング(動脈硬化)高血圧などの病態生理の解明、新たな治療法の開発に寄与できるよう願っている次第です。
ここまで忍耐強く読み通してくれたあなたを多久和研究室は熱烈に歓迎しています。出会いはその人の人生に大きく影響します。遠慮は全く不要です。興味のある方はどうぞいつでも多久和(TEL076-265-2165(直通))へご連絡ください。
このページの先頭へ